Enzimlerin çoğu proteindir. Yalnızca proteinden oluşan enzimlerin etkinlik gösterebilmeleri için başka kimyasal moleküllere gereksinim yoktur. Pepsin ve üreaz bu tür enzimlerdir. Birçok enzimin ise işlevini gerçekleştirebilmesi için protein olan kısımlarında (apoenzim) kofaktör adı verilen inorganik veya organik moleküllere gereksinim vardır.
Enzim aktivitesinde görev yapan Fe2+, Mn2+, Mg2+ ve Zn2+ vb. iyonlar inorganik kofaktörlerdir. Kofaktörler organik bir molekül ise koenzim adını alır. B grubu vitaminlerin çoğu da koenzimlerin oluşumuna öncülük eden ham maddelerdir.
Karmaşık yapılı enzimlerin esas iş yapan bölümü koenzim ya da kofaktör kısmıdır ve bu bölüm enzimin protein olan bölümüne göre daha küçüktür. Enzimin hangi maddeye etki edeceğini ise protein kısmı belirler.
Enzimlerin Özellikleri
- Enzimlerin etki ettiği maddeye substrat Enzimin substratı tanıyan kısmı protein kısmıdır. Enzimin protein kısmında aktif bölge denilen oluk ya da cep şeklinde özel bir bölüm bulunur.
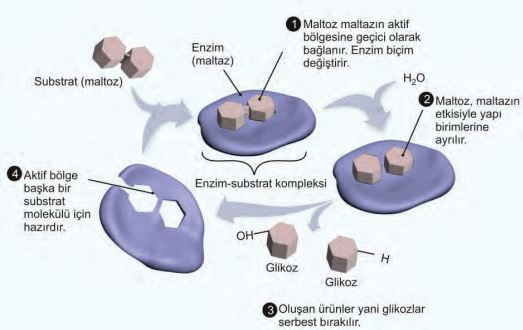
- Enzim substratına geçici olarak aktif bölgeden bağlanır. Enzim biçim değiştirerek substratı sarmalar ve substrat-enzim bileşiği (SE) meydana gelir. Enzimin etkisi sonucunda substrat ürüne dönüşür. Ürünler serbest bırakılır. Enzim eski şekline döner ve yeni bir substrata bağlanmaya hazır hâle gelir.
- Enzimler genellikle çift yönlü çalışır yani rol aldığı tepkimeler tersinirdir. Sindirim enzimleri bu genellemenin dışında tepkimeyi tek yönlü yürütecek biçimde çalışır.
- Her hücrede tepkime çeşidi kadar enzim çeşidi vardır.
- Enzimler, belirli bir koenzim ya da kofaktörle birlikte çalışır. Fakat bir koenzim ve kofaktör, birden fazla enzim ile çalışabilir. Bu nedenle enzim çeşidi, kofaktör ve koenzim çeşidinden daha fazladır.
- Enzimler çok hızlı çalışır. Örneğin vücutta hücresel solunum faaliyetleri sonucu oluşan hidrojen peroksidin (H2 O2 ) beş milyon molekülü, katalaz enziminin varlığında bir saniyede parçalanırken aynı sayıda molekül demir atomunun katalizörlüğünde vücut dışında üç yüz yılda parçalanır.
- Enzimler kimyasal tepkimelerden değişmeden çıkar ve defalarca kullanılır. Bir süre sonra yapısı bozulan enzimler parçalanır ve hücrede yeniden üretilir.
- Enzimler hücrede takım hâlinde çalışır. Bir enzimin etki ettiği tepkimenin ürünü, kendinden sonra gelecek enzimin substratı olabilir. Örneğin nişasta parçalanırken amilaz enziminin ürünü olan maltoz, maltaz enziminin substratını oluşturur.
- Takım hâlinde iş gören enzimlerin çalışmaları geri besleme mekanizması ile düzenlenir. Miktar yeterli düzeye ulaştığında son ürün ilk enzime bağlanarak enzimin çalışmasını durdurur. Takımdaki diğer enzimler de çalışamaz. Hücrede son ürün tükendiğinde takımdaki enzimler yeniden çalışmaya başlar.
- Enzimler aktif ya da inaktif durumda olmalarına göre adlandırılır. Enzim inaktif durumda iken substratın sonuna ya da katalizlediği tepkimenin sonuna “jen” eki getirilerek adlandırılır (kimotripsinojen, pepsinojen vb.). Enzim aktif durumda ise adlandırmada genellikle substratının sonuna ya da katalizlediği tepkimenin sonuna “az” eki getirilir (oksidaz, proteaz, lipaz, ribonükleaz vb.).
- Enzimler hücrede üretilir, hücre içinde ve hücre dışında çalışır. Yapay olarak da üretilmektedir.
Vücutta hangi tip enzimlerin sentezleneceğine ilişkin bilgileri genler taşır. Hücrede DNA, RNA ve ATP sentezi için gerekli olan enzimlerin üretilmemesi hücrenin ölümüne neden olur.
Ayrıca bakınız: